26 mai 2023
Philips publie les derniers résultats du programme complet des tests et essais effectués pour les appareils de traitement du sommeil par PPC et BiPAP
Amsterdam, Pays-Bas – Royal Philips (NYSE: PHG, AEX: PHIA) publie aujourd'hui les nouveaux résultats du programme complet de tests et essais de sa filiale Philips Respironics afin de mieux évaluer la nature des risques potentiels liés à la mousse d'insonorisation en polyuréthane à base de polyester (PE-PUR) utilisée dans certains appareils de PPC, BiPAP et ventilateurs mixtes dans le cadre de la notification de sécurité émise en Juin 2021. Les évaluations du risque sont désormais finalisées pour les appareils de traitement du sommeil par PCC et BiPAP concernés par la notification de sécurité, c'est à dire les DreamStation de première génération, les System One et DreamStation Go, représentant environ 95% des appareils enregistrés au total. Les évaluations s'appuient également sur les précédents rapports de décembre 2021, juin 2022 et décembre 2022. En outre, des tests et des analyses ont été réalisés pour les appareils DreamStation de première génération qui ont été exposés au nettoyage à l'ozone.
Méthodes de test
Le programme de tests et essais a été conduit en collaboration avec cinq laboratoires d'essais indépendants et certifiés, et les résultats ont été revus et évalués par des experts tiers qualifiés indépendants, par Philips Respironics ainsi que par un panel médical externe indépendant. Les méthodes d’essais appliquées - comprenant planification des essais, exécution des tests et interprétation des résultats pour une évaluation complète des risques - sont conformes aux normes industrielles ISO 18562 [1,2] et ISO 10993 [3] applicables. La méthodologie d'essai appliquée a été scientifiquement étayée sur la base d'un examen approfondi et d'une atténuation des limites inhérentes à toute norme d'essai et/ou recherche scientifique. Par exemple, les tests ont été effectués sur plusieurs appareils usagés, avec différentes durées d'utilisation par les patients et différents degrés de dégradation visuelle de la mousse, ainsi que sur des mousses vieillies en laboratoire, volontairement dégradées à différents niveaux. D'autres exemples sont fournis à la fin de ce communiqué de presse. "Notre priorité absolue est la santé et le bien-être des patients ", a déclaré Roy Jakobs, PDG de Royal Philips.
Résultats pour les appareils de traitement du sommeil non exposés au nettoyage à l'ozone
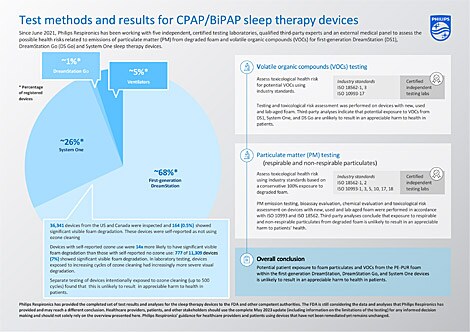
Les résultats du programme complet de tests et essais pour les appareils DreamStation de première génération, System One et DreamStation Go indiquent que l’exposition potentielle des patients aux émissions de matières particulaires (MP) et composés organiques volatils (COV) provenant de la mousse PE-PUR de ces dispositifs, est peu susceptible d’entrainer un préjudice significatif pour la santé des patients. Les tests effectués et les conclusions sont résumés dans le tableau ci-dessous.
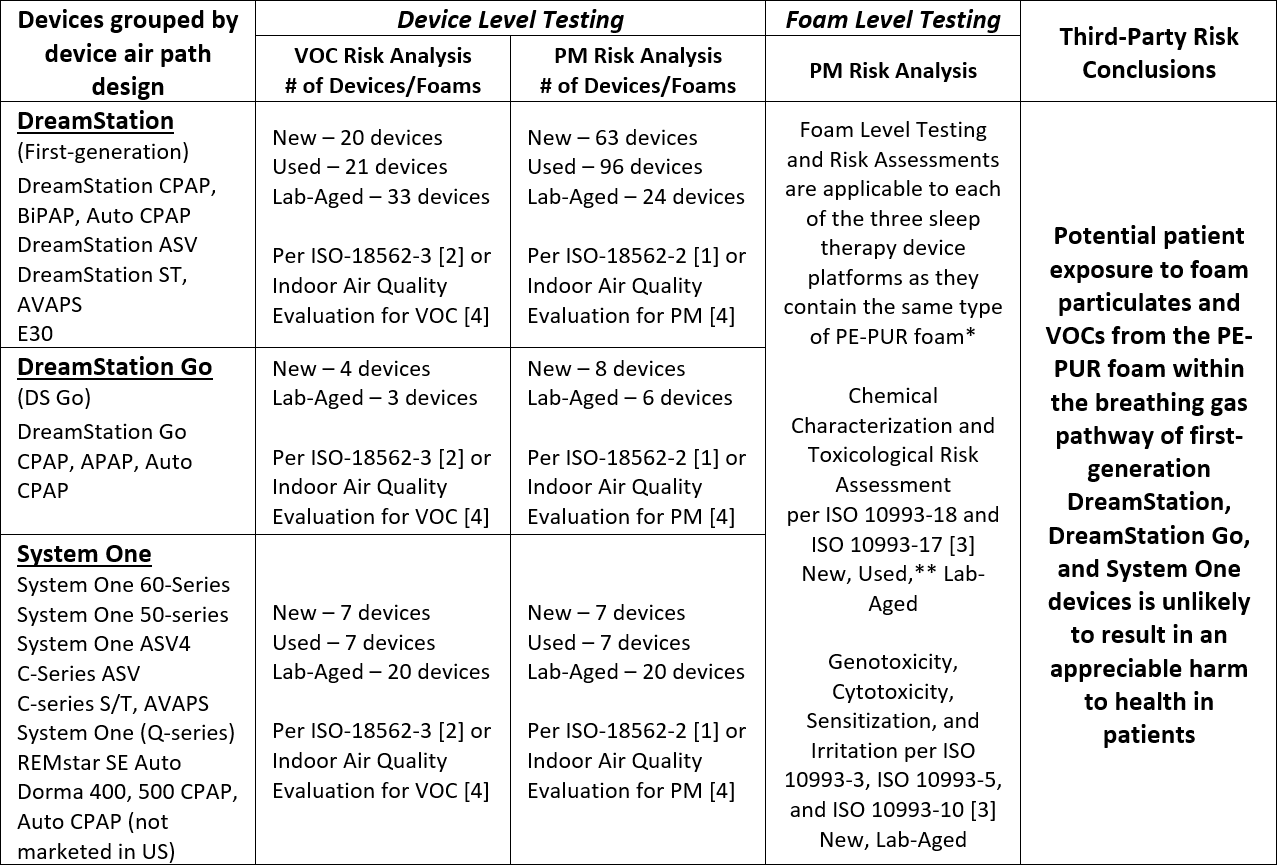
COV: Composés Organiques volatils MP: Matières Particulaires *La quantité totale de mousse dans les appareils varie d'environ 1 g à 10 g, en fonction de la conception et de la configuration du circuit d’air de l'appareil. Les dispositifs de chacune des plateformes ont la même conception et configuration du circuit d’air, y compris la quantité de mousse présente. ** La mousse de 7 appareils différents de DreamStation, de première génération, utilisés en réel a été caractérisée chimiquement conformément à la norme ISO 10993-18 et -17 [3] et comprenait des mousses dans différents états de dégradation visuelle de façon représentative
En outre, les émissions de MP testées des dispositifs utilisés en réel présentant une dégradation de la mousse n'étaient pas statistiquement différentes des émissions de MP des dispositifs utilisés en réel sans dégradation, ce qui suggère que la dégradation n'a pas contribué à des niveaux élevés de particules respirables dans les appareils testés.
Même en partant de l'hypothèse très prudente et théorique que l’ensemble de la mousse PE-PUR pourrait se dégrader et qu’un patient serait alors exposé à toute la mousse PE-PUR dégradée contenue dans le dispositif, l'évaluation des risques réalisée par un organisme tiers a conclu qu'il est peu probable que l'exposition aux particules provenant de la mousse dégradée de ces dispositifs, y compris les particules respirables et non respirables potentielles, entraîne un préjudice significatif pour la santé des patients.
L'impact du nettoyage à l'ozone sur la dégradation de la mousse PE-PUR sur les appareils DreamStation de première génération
Philips Respironics a finalisé les tests et essais pour les modèles d'appareils DreamStation de première génération exposés au nettoyage à l'ozone :
Résumé des tests en cours
Philips Respironics est en train d'achever divers autres tests et analyses restants. Les évaluations du risque pour les appareils System/PR One et DreamStation Go (contenant la même mousse que les appareils DreamStation de première génération) exposés au nettoyage à l’ozone ont été finalisées. Pour les ventilateurs Trilogy 100/200 et Omnilab Advanced Plus, les tests sur les COV et particules se poursuivent, ainsi que l’évaluation chimique et l’évaluation des risques toxicologiques. Ces appareils contiennent un type de mousse PE-PUR différent de celui des appareils DreamStation de première génération. Philips Respironics prévoit de fournir une mise à jour de ces tests au troisième trimestre 2023.
Recommandations aux prestataires de santé et aux patients
Il est demandé aux patients utilisant un appareil de PCC ou BiPAP qui n’a pas encore été remplacé ni enregistré, de le faire enregistrer afin de faciliter son remplacement. Philips Respironics continue de conseiller aux patients utilisant les appareils de PPC ou BiPAP concernés qui n’ont pas été remplacés, de contacter leur médecin ou leur prestataire de santé à domicile pour décider d'un traitement adapté à leur situation, qui peut inclure l'arrêt de l'utilisation de leur appareil, la poursuite de l'utilisation de l'appareil concerné, l'utilisation d'un autre appareil similaire ne faisant pas l'objet d’une notification de sécurité ou le recours à des traitements alternatifs du syndrome d’apnées du sommeil. En outre, il est conseillé aux patients de suivre les instructions et les recommandations de Philips Respironics concernant le nettoyage et le remplacement de leur appareil et de ses accessoires. Le nettoyage à l'ozone et à la lumière UV ne sont pas des méthodes de nettoyage actuellement approuvées pour les appareils ou les masques et ne doivent pas être utilisées. Philips Respironics recommande également aux utilisateurs de ventilateurs à domicile de contacter leurs prestataires de santé à domicile avant d'apporter des modifications à leur traitement.
Fondement scientifique des méthodes d'essais
La méthodologie d’essai appliquée a été scientifiquement étayée sur la base d'un examen approfondi et d'une atténuation des limites de tests inhérentes à toute norme d’essai et/ou recherche scientifique. Pour illustrer cela, des exemples de ces considérations et atténuations ont été énumérés ci-dessous.
Le fondement scientifique des méthodes d'essais appliquées comprenait un examen approfondi et une réduction des limites des essais, par exemple:
*Il s’agit d’une notification de rappel pour les États-Unis uniquement, et d’une notification de sécurité assortie d’une action corrective pour la France notamment. [2] ISO 18562-3 : Évaluation de la biocompatibilité des voies de gaz respiratoires dans les applications de soins de santé - Partie 3 : Essais concernant les émissions de composés organiques volatils (COV).
[1] ISO 18562-2 : Évaluation de la biocompatibilité des voies de gaz respiratoires dans les applications de soins de santé - Partie 2 : Essais concernant les émissions de matières particulaires.
[3] ISO 10993 : Évaluation biologique des dispositifs médicaux ; Partie 1 : Évaluation et essais au sein d’un processus de gestion du risque ; Partie 3 : Essais concernant la génotoxicité, la cancérogénicité et la toxicité sur la reproduction ; Partie 5 : Essais concernant la cytotoxicité in vitro ; Partie 10 : Essais d'irritation et de sensibilisation cutanée ; Partie 17 : Établissement des limites admissibles des substances relargables ; Partie 18 : Caractérisation chimique des matériaux des dispositifs médicaux dans le cadre d'un processus de gestion du risque.
[4] La norme utilisée pour les essais avant la norme ISO 18562.
[5] Les appareils DreamStation, SystemOne et DreamStation Go de première génération contiennent de la mousse PE-PUR de type A, tandis que les appareils Trilogy 100/200 contiennent de la mousse PE-PUR de type B et les appareils OmniLab Advanced Plus contiennent des mousses PE-PUR de type A et B. Les différences connues entre les mousses de type A et de type B sont que la mousse de type B peut être utilisée avec un adhésif acrylique sensible à la pression, qu'elle a une densité plus faible, une épaisseur différente et qu'elle contient également un additif pour réduire l'inflammabilité potentielle.
À propos de Royal Philips
Royal Philips (NYSE: PHG, AEX: PHIA) est une entreprise technologique leader dans le domaine des technologies de la santé. Avec son siège aux Pays-Bas, elle a pour principale mission d’améliorer la santé et le bien-être des personnes au travers de solutions et services appropriés autour du Continuum de Santé: Mode de vie sain, Prévention, Diagnostic, Traitement et Soins à domicile. Philips utilise des technologies de pointe et s’appuie sur les retours des professionnels de la santé et des consommateurs pour concevoir des solutions intégrées. L’entreprise est leader dans les domaines de l’imagerie diagnostique, de la thérapie guidée par imagerie, des systèmes de surveillance des patients et de l’informatique clinique, ainsi que des produits de santé grand public et des soins à domicile. Philips emploie près de 74’000 personnes dans plus de 100 pays et a réalisé en 2022 un chiffre d’affaires de 17,2 milliards d’euros. En savoir plus sur Philips: www.philips.ch/fr/healthcare